Práctica 14: Extracción ADN vegetal
1.OBJETIVO
Visualizar ADN vegetal de una forma casera.2.FUNDAMENTO
El ADN se encuentra en el interior del núcleo celular, disperso, muy replegado y unido a proteínas formando la cromatina. Para poder extraerlo es necesario romper las células y separar el núcleo para después volver a romperlo y liberar el ADN. Cuando el ADN es liberado es necesario separarlo de las proteínas y provocar la precipitación de éstas para poder extraer el ADN.
3.MATERIAL
- Agua destilada
- Espinacas
- Sal (NaCl)
- Zumo de piña
- Detergente
- Alcohol
- Tubo de ensayo
- Balanza de precisión
- Vaso de precipitado
- Probeta
- Espátula
- Papel de filtro
- Embudo
- Varilla de vidrio
4.PROCEDIMIENTO
Pesamos medio vaso de precipitado de espinacas, tarándolo e introduciendo poco a poco las espinacas hasta llegar a la mitad aproximadamente. Apuntamos el peso de las espinacas: 26'45 g.
Introducimos al vaso de precipitado que contiene las espinacas 200 ml de agua destilada. Para medirlos usaremos una probeta adecuada al volumen que necesitamos, vertiendo en ella el agua destilada presionando el frasco lavador. Y enrasaremos gota a gota con la pipeta Pasteur.
Pesamos una pizca de sal (NaCl) en un vidrio de reloj sobre balanza previamente limpia, taramos y echamos la pizca de sal. Apuntamos el peso: 0'24g
Con la espátula añadiremos la sal al vaso de precipitado con agua y espinacas.
Vertemos el contenido del vaso de precipitado en la batidora y la hacemos funcionar. Lo dejaremos batir hasta obtener una disolución homogénea. 
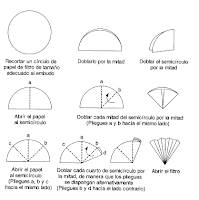
Mientras tanto, haremos un filtro con papel de filtro de la siguiente manera:
Filtramos la disolución de espinacas, colocamos el filtro hecho anteriormente en el embudo con el que tomamos la referencia, y su parte delgada (inferior) la pondremos encima de un matraz que tenga una boca grande, quedándose el tubo del embudo dentro de dicho recipiente.
Mediremos el volumen obtenido. Le tendremos que añadir 1/6 de detergente del volumen total a la disolución inicial; en nuestro caso, fueron 40 ml de detergente . Medimos los 40ml con la probeta anterior y los verteremos en la mezcla; tendremos que estar bastante rato con la probeta boca abajo para que caiga la cantidad máxima posible de detergente, ya que tiene una elevada viscosidad y, por tanto, tendencia a quedarse en las paredes de la probeta. Seguidamente mezclaremos la disolución lentamente para que se produzcan las mínimas burbujas posibles.
Con la pipeta Pasteur extraeremos líquido de la disolución y lo trasvasaremos al tubo de ensayo.
Introducimos aproximadamente 2 ml de zumo de piña con la pipeta Pasteur al tubo de ensayo y finalizaremos vertiendo alcohol de 96º hasta llegar a su capacidad máxima. Ponemos el tapón y esperaremos 2-3h. El resultado es el siguiente:

6.CONDICIONES DE SEGURIDAD
- Mantenimiento del orden en el área de trabajo.
- Examinar el estado de las piezas antes de utilizarlas.
- Desechar el material que haya sufrido un golpe,aunque no se observen grietas o fracturas.
- Evitar que entren en contacto las manos o conductores eléctricos directamente con la toma de corriente de la balanza.
- Evitar usar la balanza con las manos mojadas.
- Evitar la entrada de agua al sistema eléctrico.
7. GESTIÓN DE RESIDUOS.
Los residuos generados se eliminaron en una papelera común del laboratorio.












Comentarios
Publicar un comentario